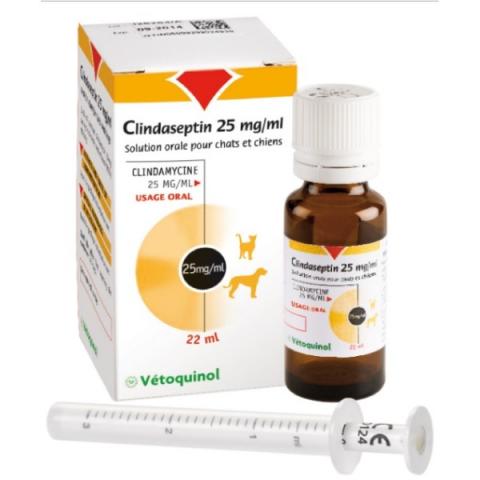
CLINDASEPTIN 22ML | ANTIINFECCIOSO PARA PERRO Y GATOS ORAL
€48,48
CLINDASEPTIN Indicado para el tratamiento de heridas infectadas y abscesos causadas por especies sensibles a clindamicina.
CLINDASEPTIN
25 mg/ml SOLUCIÓN ORAL PARA GATOS Y PERROS.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml contiene:
Sustancia activa:
| Clindamicina | 25 mg |
| (como hidrocloruro de clindamicina 27,15 mg) | |
| Excipientes(s):
|
|
| Etanol 96 % | 90,56 mg |
| Para la lista completa de excipientes, véase la sección 6.1. | |
- FORMA FARMACÉUTICA
Solución oral.
Solución clara, incolora
4. DATOS CLÍNICOS
4.1 Especies de destino
Gatos y perros
4.2 Indicaciones de uso, especificando las especies de destino
Gatos:
Indicado para el tratamiento de heridas infectadas y abscesos causadas por especies sensibles a clindamicina de Staphylococcus spp y Streptococcus spp.
Perros:
Para el tratamiento de heridas infectadas, abscesos e infecciones de la cavidad bucal /dientes causadas por, o asociadas a especies sensibles a clindamicina de Staphylococcus spp., Streptococcus spp., Bacteroides spp., Fusobacterium necrophorum, Clostridium perfringens.
Tratamiento adyuvante de la terapia periodental mecánica o quirúrgica en el tratamiento de las infecciones del tejido gingival y periodental.
Para el tratamiento de osteomielitis causadas por Staphylococcus aureus.
4.3 Contraindicaciones
No administrar en conejos, hamsters, cobayas, chinchillas, caballos o rumiantes ya que la
ingestión de clindamicina por estas especies puede causar desordenes gastrointestinales
severos.
No usar en caso de hipersensibilidad a la clindamicina o la lincomicina, o a alguno de los
excipientes.
4.4 Advertencias especiales para cada especie de destino
No procede
Precauciones específicas que debe tomar la persona que administre el medicamento a los animales
Lávese las manos después de administración.
Las personas con hipersensibilidad conocida a las lincosamidas (lincomicina y clindamicina)
deben evitar todo contacto con el medicamento veterinario
En caso de autoadministración accidental, consulte con un médico inmediatamente y muéstrele
el prospecto o la etiqueta.
Otras precauciones
Ninguna
4.9 Posología y vía de administración
Únicamente para administración oral.
Dosis recomendadas:
Gatos:
Heridas infectadas, abscesos: 11 mg de clindamicina por kg de peso corporal cada 24 horas o
5,5 mg /kg de peso corporal cada 12 horas durante 7 a 10 días.
El tratamiento debe suspenderse si no se observan efectos terapéuticos después de 4 días.
Perros:
Heridas infectadas, abscesos e infecciones de la cavidad bucal o dentales: 11 mg de
clindamicina por kg de peso corporal cada 24 horas o 5,5 mg/kg de peso corporal cada 12
horas durante 7 a 10 días.
El tratamiento debe suspenderse si no se observan efectos terapéuticos después de 4 días.
Tratamiento de infecciones en huesos (osteomielitis): 11 mg de clindamicina por kg de peso
corporal cada 12 horas durante un período mínimo de 28 días. El tratamiento debe
suspenderse si no se observan efectos terapéuticos después de 14 días.
| Dosis | Volumen para ser administrado por kg de peso corporal |
| 5,5 mg/kg | Corresponde aproximadamente a 0,25 ml por kg |
| 11 mg/kg | Corresponde aproximadamente a 0,5 ml por kg |
Se incluye una jeringa graduada de 3 ml para facilitar la administración del medicamento
veterinario.
4.10 Sobredosificación (síntomas, medidas de urgencia, antídotos), en caso necesario
Dosis de 300 mg/kg de peso corporal fueron toleradas en perros sin efectos adversos.
Ocasionalmente se observaron vómitos, perdida de apetito, diarrea, leucocitosis y elevación de
las enzimas hepáticas (AST, ALT). En tales casos, suspender inmediatamente el tratamiento y
establecer un tratamiento sintomático.
4.11 Tiempo de espera
No procede.
6.1 Lista de excipientes
Etanol 96 %
Sorbitol, líquido no cristalizable
Edetato de disodio
Propilenglicol
Sacarina sódica
Ácido cítrico monohidratado
Agua purificada
6.2 Incompatibilidades
No mezclar con ningún otro medicamento veterinario
6.3 Período de validez
Período de validez del medicamento veterinario acondicionado para su venta: 1 año
Período de validez después de abierto el envase primario: 28 días
6.4. Precauciones especiales de conservación
Este medicamento veterinario no requiere condiciones especiales de conservación.
6.5 Naturaleza y composición del envase primario
Caja con un vial transparente de polietileno tereftalato (PET) de 22 ml con cierre de seguridad
HDPE/LDPE y jeringa dosificadora de polietileno de baja densidad.
6.6 Precauciones especiales para la eliminación del medicamento veterinario no
utilizado o, en su caso, los residuos derivados de su uso
Todo medicamento veterinario no utilizado o los residuos derivados del mismo deberán eliminarse
de conformidad con las normativas locales
CLINDASEPTIN
| Peso | 0,200 kg |
|---|---|
| Dimensiones | 10 × 10 × 10 cm |
3 valoraciones en CLINDASEPTIN 22ML | ANTIINFECCIOSO PARA PERRO Y GATOS ORAL
Solo los usuarios registrados que hayan comprado este producto pueden hacer una valoración.




Maria (propietario verificado) –
No lo he utlizado al ver la advertencia sobre los efectos en snimales con insuficiencia renal
Janna (propietario verificado) –
Muy bien
Janna (propietario verificado) –